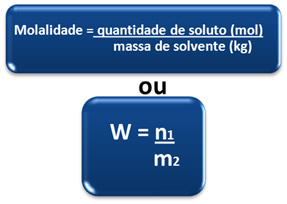
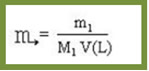EXERCÍCIOS
COMPLEMENTARES DE QUÍMICA
Entrega do trabalho para o dia 21/02/13
Escola Estadual
_____________________
Aluno(a):
__________________________
Nº:_____ turma:
_______ Data: _________
Professora: Acácia de
Paula
01- No texto: “Um escultor recebe um bloco
retangular de mármore e, habilmente, o transforma na estátua de uma celebridade
do cinema”, podemos identificar matéria, corpo e objeto e, a partir daí,
definir esses três conceitos.
I. Matéria (mármore): tudo
aquilo que tem massa e ocupa lugar no espaço.
II. Corpo (bloco retangular de
mármore): porção limitada de matéria que, por sua forma especial, se presta a
um determinado uso.
III. Objeto (estátua de
mármore): porção limitada de matéria.
Assinale
a) se somente a afirmativa I
é correta.
b) se somente a afirmativa
II é correta.
c) se somente a afirmativa
III é correta.
d) se somente as afirmativas
I e II são corretas.
e) se as afirmativas I, II e
III são corretas.
02- Julgue os itens abaixo,
indicando aqueles que se referem a propriedades químicas das substâncias e,
aqueles que se referem a propriedades físicas das substâncias.
1) A glicose é um sólido
branco.
2) O etanol entra em
ebulição a 78,5°C.
3) O éter etílico sofre
combustão.
4) O sódio metálico é um
sólido mole e de baixo ponto de fusão.
5) O metabolismo do açúcar no
corpo humano leva à produção de dióxido de carbono e água
03- Após uma aula sobre
propriedades físicas da matéria, um professor de química entregou a um de seus
alunos dois recipientes, A e B (mostrados abaixo), fechados, sem rótulos (sem
identificação), contendo um recipiente apenas água líquida e outro, benzeno
líquido, ambos puros e incolores. Para identificar as substâncias sem abrir os
recipientes, o aluno colocou-os num banho de gelo e, após certo tempo, notou
que no recipiente A existia uma fase sólida na superfície e, no recipiente B,
observou a presença de fase sólida no fundo (vide figura).
Julgue os itens:

1) O recipiente A contém água.
2) A fase sólida de qualquer substância tem
densidade maior que a de sua fase líquida.
3) O aluno não usou nenhum dado de
propriedade física para ajudá-lo na identificação das substâncias contidas nos
recipientes A e B.
4) Benzeno e água são imiscíveis,
porque têm densidades diferentes.
04 - Calcule a densidade
das seguintes substâncias:
Sabe-se que a = 1 cm; a massa do
ferro = 7,8 g; a massa do chumbo = 11,3 g e a massa do mercúrio = 13,6 g.
05 - Para saber se o benzeno é mais
volátil do que o ortoxileno, deve- se consultar uma tabela de
a) densidades.
b) calores de combustão.
c) temperaturas de ebulição.
d) temperaturas de fusão.
e) calores de formação.
06 - Para identificar três
líquidos - de densidades 0,8, 1,0 e 1,2 - o analista dispõe de uma pequena bola
de densidade = 1,0. Conforme a posição das bolas apresentadas no desenho
abaixo, podemos afirmar que:
a) os líquidos contidos nas provetas 1, 2 e 3
apresentam densidades 0,8, 1,0 e 1,2.
b) os líquidos contidos nas provetas 1, 2 e 3
apresentam densidades 1,2, 0,8 e 1,0.
c) os líquidos contidos nas provetas 1, 2 e 3
apresentam densidades 1,0, 0,8 e 1,2.
d) os líquidos contidos nas provetas 1, 2 e 3
apresentam densidades 1,2, 1,0 e 0,8.
e) os líquidos contidos nas
provetas 1, 2 e 3 apresentam densidades 1,0, 1,2 e 0,8.
07 - Três frascos não-rotulados
encontram-se na prateleira de um laboratório. Um contém benzeno, outro,
tetracloreto de carbono e o terceiro, metanol. Sabe-se que as suas densidades
são: 0,87 g/cm3(benzeno); 1,59 g/cm3 (tetracloreto de carbono) e 0,79 g/cm3
(metanol). Dos três líquidos, apenas o metanol é solúvel na água, cuja
densidade é 1,00 g/cm3. Com base nessas informações, explique como você faria
para reconhecer os três líquidos.
Observação - Os três líquidos são
altamente tóxicos e não devem ser cheirados.
08 - Determinou-se o ponto de fusão de
uma substância X e encontrou-se um valor menor que o tabelado para essa
substância. Isso pode significar que
a) a quantidade de substância utilizada na
determinação foi menor que o necessário.
b) a quantidade de substância utilizada na
determinação foi maior que o necessário.
c) uma parte da substância não fundiu.
d) a substância contém impurezas.
e) a substância está 100% pura.
09 - Julgue os itens abaixo:
0) Qualquer porção de qualquer material
possui massa e ocupa lugar no espaço.
1) Quando afirmamos que a densidade doalumínio
é de 2,7 g/cm3, estamos afirmando que , se pesarmos um volume de alumínio puro
igual a 1 cm3, obteremos uma massa de 2,7 g.
2) Quando dois materiais possuem densidades diferentes, sob a mesma
pressão e temperatura, podemos afirmar que se trata de materiaisdiferentes.
3) Quando temos volumes iguais de materiais
diferentes, o material de maior densidade apresenta maior massa.
4) Quando temos massas iguais de
materiais diferentes, o material de maior densidade apresenta o maior volume.
10 - Dentre as opções abaixo, marque a
que apresenta fortes indícios de que a amostra nela descrita é um elemento.
a) Um sólido azul que é separado em dois por
método físico.
b) Um líquido preto que apresenta faixa de
temperatura durante a ebulição.
c) Um líquido incolor que se transforma em
sólido incolor por resfriamento.
d) Um sólido branco que, por aquecimento, se
torna amarelo e, depois, novamente branco, ao resfriar.
e) Um sólido preto que queima
completamente em oxigênio, produzindo um único gás incolor.
11 - Numa indústria de fabricação do
metanol, CH3OH, a queda acidental do álcool no reservatório de água potável
tornou-a imprópria para o consumo. Apesar do incidente, duas características da
água potável permaneceram inalteradas:
a) cor e densidade.
b) sabor e ponto de ebulição.
c) odor e calor específico.
d) cor e condutividade elétrica.
e) sabor e ponto de fusão.
12 - Ponto de fusão, densidade e
solubilidade são algumas constantes físicas que caracterizam:
a) mistura homogênea.
b) apenas substância simples.
c) mistura heterogênea.
d) substância pura.
e) apenas substância composta.
13 - Uma observação é simplesmente um
registro do que ocorreu na experiência ou no fenômeno. Uma interpretação inclui
referência ao significado, a implicações ou a relações indiretas com outras
observações. Com relação à combustão de uma vela, qual das afirmações é mais
uma interpretação do que uma observação?
a) A parte superior da vela toma a forma de
uma concha na qual há um líquido incolor.
b) O barbante, ou pavio, acende quando um
palito de fósforo aceso fica perto dele por alguns segundos.
c) A forma da chama assemelha-se a uma
lágrima alongada.
d) A vela arde, produzindo dióxido de carbono
e água.
e) A vela arde, fornecendo luz e
calor.
14 - Observe os seguintes fatos:
I) Uma pedra de naftalina deixada no armário.
II) Uma vasilha com água deixada no freezer.
III) Uma vasilha com água deixada no fogo.
IV) O derretimento de um pedaço de chumbo
quando aquecido.
Nestes fatos estão relacionados
corretamente os
seguintes fenômenos:
a) I - sublimação; II - solidificação; III -
evaporação; IV - fusão
b) I - sublimação; II - solidificação; III -
fusão; IV - evaporação
c) I - fusão; II - sublimação; III -
evaporação; IV - solidificação
d) I - evaporação; II - solidificação; III -
fusão; IV - sublimação
e) I - evaporação; II -
sublimação; III - fusão; IV – solidificação
15 - O gráfico abaixo
representa a densidade de três substâncias arbitrariamente designadas como X, Y
e Z.
Julgue as afirmações abaixo em (V) verdadeiro
ou (F) falso.
I) A densidade da substância X é maior que a
da substância Z.
II) Nas mesmas condições de temperatura e
pressão, massas iguais das substâncias X e Y ocupam o mesmo volume.
III) A densidade aproximada da
substância Y é de 0,5 g/mL.
16 - Dos procedimentos enunciados a
seguir, o mais indicado quando se quer distinguir entre uma porção de água
destilada e uma solução de água salgada, sem levar à boca, é:
a) Filtrar os líquidos.
b) Observar as diferentes colorações.
c) Medir a condutividade elétrica.
d) Usar papel de tornassol.
e) Decantar os líquidos.
17 - Considere as seguintes
propriedades dos metais estanho e chumbo:

Certa liga de solda utilizada na fixação de
componentes em circuitos eletrônicos contém 63 % de estanho e 37 % de chumbo
(porcentagens em massa). Com base nessas informações, afirma-se que tal liga
I. apresenta maior temperatura de fusão do
que o estanho puro;
II. apresenta densidade igual a 9,4 g/cm¤;
III. é boa condutora de corrente elétrica.
É correto o que se afirma somente em
a) I.
b) II.
c) III.
d) I e III.
e) II e III.
18 - O
hábito de tomar café está ligado a atividades sociais e de interação entre as
pessoas. O "cafezinho" é uma bebida capaz de unir pessoas num bate
papo, de propiciar momentos de descontração durante o período de trabalho ou de
encerrar uma reunião de amigos. Esse consumo tem levado os produtores de café a
melhorar o processo e aprimorar o grão, o que resulta em tipos diversos de
café, que são classificados, dentre outros critérios, pela acidez, amargor,
aroma, defeitos dos grãos, doçura, processo de beneficiamento, torrefação,
infusão e filtragem. Considere as afirmações a seguir relacionadas às
características citadas.
I. A acidez é uma propriedade que
está relacionada com o pH, o qual apresenta uma escala que varia de 0 a 14.
II. O amargor, o aroma e a doçura são
propriedades organolépticas do café que podem ser sentidas pelo consumidor.
III. A torrefação e a filtragem são processos
para separação de misturas, entre os grãos e a terra e entre o pó e o líquido,
respectivamente.
IV. O beneficiamento (retirada da casca dos
grãos) e a moagem (trituração dos grãos) são processos químicos.
É válido o que se afirma em
a) I e II, apenas.
b) I e III, apenas.
c) I, II e III, apenas.
d) II, III e IV, apenas.
e) I, II, III e IV.
19 - Em um laboratório de química,
foram encontrados cinco recipientes sem rótulo, cada um contendo uma substância
pura líquida e incolor. Para cada uma dessas substâncias, um estudante
determinou as seguintes propriedades:
1. ponto de ebulição
2. massa
3. volume
4. densidade
Assinale as propriedades que podem permitir
ao estudante a identificação desses líquidos.
a) 1 e 2
b) 1 e 3
c) 2 e 4
d) 1 e 4
20 - Algumas propriedades físicas são
características do conjunto das moléculas de uma substância, enquanto outras
são atributos intrínsecos a moléculas individuais.
Assim sendo, é CORRETO afirmar que uma
propriedade intrínseca de uma molécula de água é a:
a) densidade.
b) polaridade.
c) pressão de vapor.
d) temperatura de ebulição.
21 - As propriedades de um material
utilizadas para distinguir-se um material do outro são divididas em
Organolépticas, Físicas e Químicas. Associe a primeira coluna com a segunda
coluna e assinale a alternativa que apresenta a ordem correta das respostas.
PRIMEIRA COLUNA
(A) Propriedade Organoléptica
(B) Propriedade Física
(C) Propriedade Química
SEGUNDA COLUNA
( ) Sabor
( ) Ponto de Fusão
( ) Combustibilidade
( ) Reatividade
( ) Densidade
( ) Odor
( ) Estados da Matéria
a) A, B, C, C, B, A, B
b) A, B, C, A, B, C, B
c) A, C, B, C, B, C, B
d) A, B, C, B, B, A, B
e) C, B, A, C, B, A, B
22 - Quimicamente falando, não se deve
tomar água .................., mas apenas água ................... . A água
.................. inúmeros sais, por exemplo, o cloreto de ..................,
o mais abundante na água do mar. Em regiões litorâneas, ameniza variações
bruscas de temperatura, graças à sua capacidade de armazenar grande quantidade
de energia térmica, o que se deve ao seu alto ..................... . Na forma
de suor, sua evaporação abaixa a temperatura do corpo humano, para o que
contribui seu elevado .................... .
Completa-se corretamente o texto,
obedecendo-se a ordem em que as lacunas aparecem, por:
a) pura, potável, dissolve, sódio, calor
específico, calor de vaporização.
b) de poço, pura, dissolve, magnésio, calor específico, calor de
vaporização.
c) destilada, potável, dilui, sódio, calor de vaporização, calor
específico.
d) de poço, destilada, dissolve, magnésio,
calor de vaporização, calor específico.
e) pura, destilada, dilui, sódio,
calor de vaporização, calor específico.
23 - Na fabricação de
qualquer objeto metálico, seja um parafuso, uma panela, uma jóia, um carro ou
um foguete, a metalurgia está presente na extração de metais a partir dos
minérios correspondentes, na sua transformação e sua moldagem. Muitos dos
processos metalúrgicos atuais têm em sua base conhecimentos desenvolvidos há
milhares de anos, como mostra o quadro:
Podemos observar que a extração e o uso de
diferentes metais ocorreram a partir de diferentes épocas. Uma das razões para
que a extração e o uso do ferro tenham ocorrido após a do cobre ou estanho é
a) a inexistência do uso de fogo que
permitisse sua moldagem.
b) a necessidade de temperaturas mais
elevadas para sua extração e moldagem.
c) o desconhecimento de técnicas para a
extração de metais a partir de minérios.
d) a necessidade do uso do cobre na
fabricação do ferro.
e) seu emprego na cunhagem de
moedas, em substituição ao ouro.
24 - A naftalina, nome comercial do
hidrocarboneto naftaleno, é utilizada em gavetas e armários para proteger
tecidos, papéis e livros do ataque de traças e outros insetos. Assim como
outros compostos, a naftalina tem a propriedade de passar do estado sólido para
o gasoso sem fundir-se. Esse fenômeno é chamado de:
a) liquefação.
b) sublimação.
c) combustão.
d) ebulição.
e) solidificação.
25 - Certa vez uma criança
se perdeu. Como fazia frio, decidiu procurar material para atear fogo. À medida
que ia trazendo objetos para sua fogueira, observava que alguns queimavam e
outros não. Começou, então, a fazer a lista a seguir, relacionando os que
queimavam e os que não queimavam. Depois de algumas viagens, sua classificação
continha as seguintes informações:
QUEIMAM
galhos de árvore
cabos de vassoura
mastro de bandeira
lápis
NÃO QUEIMAM
rochas
cacos de vidro
pedrinhas
tijolos
A partir dessa lista, ela tentou encontrar
uma regularidade que a guiasse na procura de novos materiais combustíveis, chegando
à seguinte conclusão:
"Todos os objetos cilíndricos
queimam".
Quanto ao método científico, o procedimento e
o tipo de raciocínio utilizados pela criança, em sua conclusão, são exemplos,
respectivamente, de:
a) formulação de lei; dedutivo
b) criação de modelo; dedutivo
c) proposição de teoria; indutivo
d) elaboração de hipótese;
indutivo
27 - A dureza de um mineral
reflete a resistência deste ao risco. Uma das escalas utilizadas para verificar
a dureza de um mineral é a escala de Mohs.

De acordo com essa escala, é INCORRETO
afirmar que:
a) o diamante é o mineral mais duro.
b) apenas o coríndon risca o diamante.
c) a apatita é riscada pelo quartzo.
d) o topázio e a fluorita riscam a calcita.
e) o mineral menos duro é o talco.
35 - Dois frascos idênticos estão
esquematizados abaixo.
Um deles contém uma certa massa de
água (H2O) e o outro, a mesma massa de álcool (CH3CH2OH).
Qual das substâncias está no
frasco A e qual está no frasco B? Justifique.
39 - Em uma noite de inverno rigoroso
uma dona de casa estendeu as roupas recém lavadas no varal, expostas ao tempo.
Pela manhã as roupas congelaram, em função do frio intenso. Com a elevação da
temperatura no decorrer da manhã, começou a pingar água das roupas, em seguida
elas ficaram apenas úmidas, e elas logo estavam secas.
Ocorreram nestas roupas, respectivamente, as
seguintes passagens de estados físicos:
a) solidificação, evaporação e fusão.
b) solidificação, fusão e evaporação.
c) fusão, solidificação e evaporação.
d) fusão, evaporação e solidificação.
e) evaporação, solidificação e
fusão.
40- No
ambiente, a água apresenta-se nos estados sólido, líquido e gasoso, estando em
constante interação com o solo, com a atmosfera, com a flora e com a fauna. A
compreensão desta interação não é simples, pois a água muda de estado em
determinadas ocasiões.
No desenho temos uma representação
simplificada do ciclo da água
As mudanças de estados físicos que acontecem
em 1, 2 e 3 são, respectivamente,
a) sublimação, condensação e evaporação.
b) ebulição, condensação e evaporação.
c) ebulição, condensação e condensação.
d) evaporação, liquefação e sublimação.
e) condensação, condensação e
evaporação.
41- Referindo-se às propriedades dos estados
físicos da matéria, é INCORRETO afirmar que:
a) a mudança de estado de um material altera
o modo como as partículas se organizam e movimentam sem modificar sua natureza.
b) os sólidos apresentam máxima organização
interna e suas partículas efetuam movimentos de vibração em torno de um ponto
de equilíbrio.
c) as partículas se encontram mais distantes
umas das outras nos líquidos do que nos gases, e as forças de interação entre
elas são desprezíveis.
d) as partículas que constituem os
gases apresentam entre si grandes espaços vazios e fracas forças de interação,
favorecendo sua expansão e compressão.