Concentração em mols por litro ou molaridade

A concentração em quantidade de matéria (mol/L) é a expressão de concentração mais utilizada ao se trabalhar com soluções
 Consideremos o suco gástrico que nosso estômago produz, com a finalidade de realizar o processo de digestão. Na realidade, trata-se de uma solução de ácido clorídrico (HCl) em uma concentração de 0,01 mol/L. Isso significa que para cada litro de suco gástrico, há 0,01 mol de HCl.
A concentração em quantidade de matéria é muitas vezes chamada por alguns autores de concentração molar ou molaridade, porém, os termos corretos são“concentração em mol/L” ou“concentração em quantidade de matéria”.Além disso, essa concentração é a mais recomendada pelo Sistema Internacional de Unidades (SI) e pela União Internacional de Química pura e Aplicada (IUPAC); portanto, ela é a mais usada em laboratórios e indústrias químicas.
A fórmula matemática usada para calcular essa concentração é dada por:
Consideremos o suco gástrico que nosso estômago produz, com a finalidade de realizar o processo de digestão. Na realidade, trata-se de uma solução de ácido clorídrico (HCl) em uma concentração de 0,01 mol/L. Isso significa que para cada litro de suco gástrico, há 0,01 mol de HCl.
A concentração em quantidade de matéria é muitas vezes chamada por alguns autores de concentração molar ou molaridade, porém, os termos corretos são“concentração em mol/L” ou“concentração em quantidade de matéria”.Além disso, essa concentração é a mais recomendada pelo Sistema Internacional de Unidades (SI) e pela União Internacional de Química pura e Aplicada (IUPAC); portanto, ela é a mais usada em laboratórios e indústrias químicas.
A fórmula matemática usada para calcular essa concentração é dada por:
 Porém, em muitos casos não é fornecido o valor da quantidade de matéria do soluto, mas sim a sua massa, expressa em gramas (m1). Nesses casos, temos que a quantidade de matéria do soluto em mols (n1) pode ser conseguida pela divisão da massa do soluto pela massa molar do próprio soluto, conforme a fórmula abaixo:
Porém, em muitos casos não é fornecido o valor da quantidade de matéria do soluto, mas sim a sua massa, expressa em gramas (m1). Nesses casos, temos que a quantidade de matéria do soluto em mols (n1) pode ser conseguida pela divisão da massa do soluto pela massa molar do próprio soluto, conforme a fórmula abaixo:
 Substituindo n1 na equação, temos:
Substituindo n1 na equação, temos:
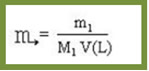 Considere o seguinte exemplo abaixo para visualizar como é feito esse cálculo:
“Uma solução aquosa com 100 mL de volume contém 20 g de NaCl. Como proceder para expressar a concentração dessa solução em quantidade de matéria por volume?”
Resolução:
Bom, a fórmula a ser utilizada é a mesma acima, porém o volume não está em litros. Assim, devemos fazer a seguinte conversão de unidades:
1 L ------ 1000 mL
Considere o seguinte exemplo abaixo para visualizar como é feito esse cálculo:
“Uma solução aquosa com 100 mL de volume contém 20 g de NaCl. Como proceder para expressar a concentração dessa solução em quantidade de matéria por volume?”
Resolução:
Bom, a fórmula a ser utilizada é a mesma acima, porém o volume não está em litros. Assim, devemos fazer a seguinte conversão de unidades:
1 L ------ 1000 mL
V ------ 100 mL
V = 0,1 L
Também é necessário descobrir o valor da massa molar do sal NaCl. Para tal, é preciso saber os valores das massas atômicas de ambos os elementos e realizar o cálculo da massa molar ensinado no texto “Massa Molar e Número de Mol”:
M (NaCl) = 1 . 23+ 1 . 35, 46
M (NaCl) = 58,46 g/mol
Agora sim podemos substituir todos os valores na fórmula e descobrir o valor da concentração em mol/L:

Concentração molal ou Molalidade
A molalidade é mais uma forma de expressar a concentração de uma solução química
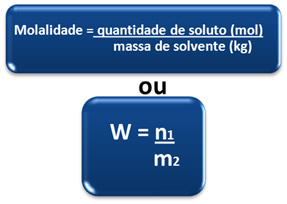
A Molalidade, normalmente representada pela letra W, é outra grandeza usada pelos químicos para expressar a concentração de uma solução. Ela pode ser definida da seguinte maneira:
 Por isso, a molalidade também é chamada de concentração em quantidade de matéria por massa e essa relação pode ser expressa pela fórmula matemática:
Por isso, a molalidade também é chamada de concentração em quantidade de matéria por massa e essa relação pode ser expressa pela fórmula matemática:
 Uma vez que n1 = m1/M1,
Uma vez que n1 = m1/M1, podemos escrever também:
 A unidade de molalidade é mols de soluto por kg de solvente (mol/kg ou mol . kg-1), mas ela é normalmente expressa pela palavra “molal” ou simplesmente “m”.
A unidade de molalidade é mols de soluto por kg de solvente (mol/kg ou mol . kg-1), mas ela é normalmente expressa pela palavra “molal” ou simplesmente “m”.
Essa grandeza é muito útil quando se trabalha com soluções cuja temperatura varia, vistoque a temperatura pode fazer com que o volume mude e o cálculo da molalidade não precisa do volume. Além disso, essa medida de concentração é proveitosa quando se estuda os aspectos relacionados às propriedades coligativas, que dependem dos números relativos de moléculas de soluto e de solvente.
Outra informação importante é que experimentalmente se constata que no caso de soluções aquosas diluídas que contêm quantidade igual ou inferior a 0,1 mol de soluto por 1 litro de água, as concentrações expressas em molaridade (mol/L) e em molalidade (W)são aproximadamente iguais numericamente.
Os passos necessários para preparar uma solução com a molalidade especificada são simples: primeiro se medem as massas necessárias de soluto e de solvente; depois se dissolve o soluto no solvente.
 Para entender como realizar os cálculos da molalidade, veja os exemplos a seguir:
Exemplo 1: “Para o preparo de uma solução, 0,5 mol de um sal foi dissolvido em 580 g de água. Vamos determinar então a concentração do soluto em mol por kg da solução.”
Para isso, podemos fazer o seguinte raciocínio:
0,58 kg (580g) de solvente dissolve 0,5 mol de soluto
Para entender como realizar os cálculos da molalidade, veja os exemplos a seguir:
Exemplo 1: “Para o preparo de uma solução, 0,5 mol de um sal foi dissolvido em 580 g de água. Vamos determinar então a concentração do soluto em mol por kg da solução.”
Para isso, podemos fazer o seguinte raciocínio:
0,58 kg (580g) de solvente dissolve 0,5 mol de soluto
1 kg de solvente dissolverá x
x = 1 kg . 0,5 mol
0,58 kg
x = 0,86 mol em 1 kg da solução = 0,86 mol/kg
Ou, então, podemos resolver essa questão substituindo os valores na fórmula da molalidade:
W = n1
m2
W = 0,5 mol
0,58 kg
W = 0,86 molal
Exemplo 2: “Qual é a molalidade da glicose num soro contendo 4 g de glicose (C6H12O6) em 100 g (0,1 kg) de água? Dado: massa molar da glicose = 180 g/mol.”
Primeiro precisamos calcular a quantidade de glicose, em mol:
1 mol -------- 180 g
X ------------- 4 g
x = 0,02 mol
Agora sim podemos calcular a molalidade da glicose no soro:
0,1 kg de água --------- 0,2 mol de glicose
1 kg ---------------------- y
y = 0,2 mol de glicose
A molalidade da glicose nesse soro é de 0,2 mol de glicose por quilograma de água.
Por Jennifer Rocha Vargas Fogaça
Fração Molar ou Fração em Mols (x)
Neste Post aprenderemos como calcular a fração molar.
Mas antes de falarmos sobre fração molar, devemos lembrar que:
Índice 1: para o Soluto
Índice 2: para o Solvente
Sem Índice: para a Solução
Agora você pode estar se perguntando "mas o que é Fração Molar?", calma que eu te explico..
Fração Molar do soluto ou Fração em Mols, é o quociente entre a quantidade de mols do soluto e a quantidade total de mols na solução (soluto + solvente).
Essa definição é representada pela fórmula:
- Para o soluto:
x1 = n1/ n
- Para o solvente:
x2 = n2/ n
obs1: a fração molar não possui unidade
obs2; o somatório de x1 e x2 tem que ser igual a 1
Sx = 1 \ x1 + x2 = 1
Exemplo: Uma solução contém 230g de álcool comum (C2H5OH) E 360g de água. Calcule as frações molares do álcool e da água na solução (massas atômicas: H = 1; C = 12; O = 16).

A concentração em quantidade de matéria (mol/L) é a expressão de concentração mais utilizada ao se trabalhar com soluções

Consideremos o suco gástrico que nosso estômago produz, com a finalidade de realizar o processo de digestão. Na realidade, trata-se de uma solução de ácido clorídrico (HCl) em uma concentração de 0,01 mol/L. Isso significa que para cada litro de suco gástrico, há 0,01 mol de HCl.
A concentração em quantidade de matéria é muitas vezes chamada por alguns autores de concentração molar ou molaridade, porém, os termos corretos são“concentração em mol/L” ou“concentração em quantidade de matéria”.Além disso, essa concentração é a mais recomendada pelo Sistema Internacional de Unidades (SI) e pela União Internacional de Química pura e Aplicada (IUPAC); portanto, ela é a mais usada em laboratórios e indústrias químicas.
A fórmula matemática usada para calcular essa concentração é dada por:

Porém, em muitos casos não é fornecido o valor da quantidade de matéria do soluto, mas sim a sua massa, expressa em gramas (m1). Nesses casos, temos que a quantidade de matéria do soluto em mols (n1) pode ser conseguida pela divisão da massa do soluto pela massa molar do próprio soluto, conforme a fórmula abaixo:

Substituindo n1 na equação, temos:
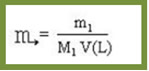
Considere o seguinte exemplo abaixo para visualizar como é feito esse cálculo:
“Uma solução aquosa com 100 mL de volume contém 20 g de NaCl. Como proceder para expressar a concentração dessa solução em quantidade de matéria por volume?”
Resolução:
Bom, a fórmula a ser utilizada é a mesma acima, porém o volume não está em litros. Assim, devemos fazer a seguinte conversão de unidades:
1 L ------ 1000 mL
V ------ 100 mL
V = 0,1 L
V ------ 100 mL
V = 0,1 L
Também é necessário descobrir o valor da massa molar do sal NaCl. Para tal, é preciso saber os valores das massas atômicas de ambos os elementos e realizar o cálculo da massa molar ensinado no texto “Massa Molar e Número de Mol”:
M (NaCl) = 1 . 23+ 1 . 35, 46
M (NaCl) = 58,46 g/mol
Agora sim podemos substituir todos os valores na fórmula e descobrir o valor da concentração em mol/L:

Concentração molal ou Molalidade

A molalidade é mais uma forma de expressar a concentração de uma solução química
A Molalidade, normalmente representada pela letra W, é outra grandeza usada pelos químicos para expressar a concentração de uma solução. Ela pode ser definida da seguinte maneira:

Por isso, a molalidade também é chamada de concentração em quantidade de matéria por massa e essa relação pode ser expressa pela fórmula matemática:

Uma vez que n1 = m1/M1, podemos escrever também:

A unidade de molalidade é mols de soluto por kg de solvente (mol/kg ou mol . kg-1), mas ela é normalmente expressa pela palavra “molal” ou simplesmente “m”.
Outra informação importante é que experimentalmente se constata que no caso de soluções aquosas diluídas que contêm quantidade igual ou inferior a 0,1 mol de soluto por 1 litro de água, as concentrações expressas em molaridade (mol/L) e em molalidade (W)são aproximadamente iguais numericamente.
Os passos necessários para preparar uma solução com a molalidade especificada são simples: primeiro se medem as massas necessárias de soluto e de solvente; depois se dissolve o soluto no solvente.

Para entender como realizar os cálculos da molalidade, veja os exemplos a seguir:
Exemplo 1: “Para o preparo de uma solução, 0,5 mol de um sal foi dissolvido em 580 g de água. Vamos determinar então a concentração do soluto em mol por kg da solução.”
Para isso, podemos fazer o seguinte raciocínio:
0,58 kg (580g) de solvente dissolve 0,5 mol de soluto
1 kg de solvente dissolverá x
1 kg de solvente dissolverá x
x = 1 kg . 0,5 mol
0,58 kg
0,58 kg
x = 0,86 mol em 1 kg da solução = 0,86 mol/kg
Ou, então, podemos resolver essa questão substituindo os valores na fórmula da molalidade:
W = n1
m2
m2
W = 0,5 mol
0,58 kg
W = 0,86 molal
0,58 kg
W = 0,86 molal
Exemplo 2: “Qual é a molalidade da glicose num soro contendo 4 g de glicose (C6H12O6) em 100 g (0,1 kg) de água? Dado: massa molar da glicose = 180 g/mol.”
Primeiro precisamos calcular a quantidade de glicose, em mol:
1 mol -------- 180 g
X ------------- 4 g
x = 0,02 mol
x = 0,02 mol
Agora sim podemos calcular a molalidade da glicose no soro:
0,1 kg de água --------- 0,2 mol de glicose
1 kg ---------------------- y
1 kg ---------------------- y
y = 0,2 mol de glicose
A molalidade da glicose nesse soro é de 0,2 mol de glicose por quilograma de água.
Por Jennifer Rocha Vargas Fogaça
Fração Molar ou Fração em Mols (x)
Neste Post aprenderemos como calcular a fração molar.
Mas antes de falarmos sobre fração molar, devemos lembrar que:
Índice 1: para o Soluto
Índice 2: para o Solvente
Sem Índice: para a Solução
Agora você pode estar se perguntando "mas o que é Fração Molar?", calma que eu te explico..
Fração Molar do soluto ou Fração em Mols, é o quociente entre a quantidade de mols do soluto e a quantidade total de mols na solução (soluto + solvente).
Essa definição é representada pela fórmula:
Mas antes de falarmos sobre fração molar, devemos lembrar que:
Índice 1: para o Soluto
Índice 2: para o Solvente
Sem Índice: para a Solução
Agora você pode estar se perguntando "mas o que é Fração Molar?", calma que eu te explico..
Fração Molar do soluto ou Fração em Mols, é o quociente entre a quantidade de mols do soluto e a quantidade total de mols na solução (soluto + solvente).
Essa definição é representada pela fórmula:
- Para o soluto:
x1 = n1/ n
- Para o solvente:
x2 = n2/ n
obs1: a fração molar não possui unidade
obs2; o somatório de x1 e x2 tem que ser igual a 1
Sx = 1 \ x1 + x2 = 1
Exemplo: Uma solução contém 230g de álcool comum (C2H5OH) E 360g de água. Calcule as frações molares do álcool e da água na solução (massas atômicas: H = 1; C = 12; O = 16).
Mistura de soluções
Mistura de Soluções
Mistura de soluções no vestibular
01- Misturam-se 200 ml de solução de hidróxido de potássio de concentração 5,0g/L com 300 ml de solução de mesma base com concentração 4,0g/L. Qual a concentração final em g/L ?
02- 150 ml de ácido clorídrico (HCl) de molaridade desconhecida são misturados a 350 ml do mesmo ácido a 2 M, dando uma solução de 2,9 M. Qual a molaridade do ácido inicial?
Curvas de solubilidade
As curvas de solubilidade são diagramas que indicam a variação dos coeficientes de solubilidade das substâncias em função da temperatura.

Por meio da análise do gráfico, observamos que regiões abaixo da curva representam solução não-saturada, sobre a curva, região saturada e acima da curva, desde que as quantidades permaneçam em solução, região supersaturada.
O gráfico abaixo representa a solubilidade de várias substâncias em função da temperatura.

O gráfico abaixo representa a solubilidade de várias substâncias em função da temperatura.

Observamos que a maioria das substâncias aumenta a solubilidade com o aumento da temperatura. Podemos dizer, então, que se trata de uma dissolução endotérmica.
Para uma substância como Ce2(SO4)3, a solubilidade diminui com o aumento da temperatura; portanto, trata-se de uma dissolução exotérmica. Este tipo de dissolução é facilmente observado para os gases. Refrigerantes promovem a formação de maior quantidade de espuma ao serem abertos quando se encontram a maiores temperaturas devido à liberação de CO2 que estava inicialmente dissolvido.
O gráfico do coeficiente de solubilidade em função da temperatura é utilizado principalmente para informar a solubilidade de uma ou várias substâncias em função da temperatura.
Por exemplo:

Interpretando o gráfico:
– na temperatura de 50 °C, a quantidade máxima de KNO3 que se dissolve em 100 g de água são 80 g. A solução em questão é saturada.
– para obtermos uma solução saturada KNO3 a 40 °C, basta dissolver 60 g de KNO3 em 100 g de água.
– se resfriarmos uma solução saturada de 50 °C para 40 °C, teremos um corpo de fundo igual a 20 g de KNO3.
– 200 g de água a 40 °C dissolvem no máximo 120 g de KNO3.

Nenhum comentário:
Postar um comentário